Comment sont encadrés les essais cliniques autorisant la vente de nouveaux médicaments?

Image d'illustration médicaments - iStock - DNY59
L'Agence du médicament (ANSM) a interdit un essai clinique mené "illégalement" sur au moins 350 malades de Parkinson ou d'Alzheimer, a-t-elle annoncé ce jeudi. Il s'agit d'un "essai clinique totalement sauvage, en dehors de toutes les règles éthiques, et de la réglementation française qui est très stricte en matière d'essai clinique sur les médicaments", a déclaré la ministre de la Santé Agnès Buzyn ce vendredi sur notre antenne. Mais quelles sont ces règles?
"Un essai clinique est une recherche biomédicale organisée et pratiquée sur l’homme en vue du développement des connaissances biologiques ou médicales", explique l'ANSM.
Il s'agit, lors de ces études, de définir le devenir du médicament une fois absorbé par l'homme, son incidence, son efficacité, mais aussi les effets indésirables qu'il peut développer.
Quelles sont les autorisations nécessaires pour lancer un essai clinique?
"Pour débuter, l'essai doit avoir obtenu un avis favorable du Comité de protection des personnes (C.P.P.) et une autorisation de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM)", explique l'ANSM.
Ces organismes valident le lancement de la recherche, et le cadre dans laquelle elle est menée: consentement des personnes, protection des patients, pertinence de la recherche, qualification des médecins qui participent à la recherche ou encore modalité de recrutement des participants. Ils peuvent par exemple arrêter un essai jugé trop dangereux ou peu scrupuleux.
Les acteurs concernés par le test sont détaillés par le ministère de la Santé: le promoteur est la "personne physique ou morale qui prend l’initiative de la recherche, qui en assure la gestion et vérifie que son financement est prévu". Les investigateurs sont "les médecins qui réalisent la recherche en pratique" et enfin les volontaires sont les "personnes saines ou malades qui se prêtent à la recherche, après avoir été dûment informées des objectifs de la recherche et de son déroulement".
Quelles sont les étapes d'un essai clinique?
Le Leem, l'organisation professionnelle des entreprises du médicament, distingue quatre phases d'étude du médicament. D'abord les médecins estiment le dosage nécessaire et le potentiel toxique du médicament sur un petit panel. Ensuite, si le médicament n'est pas toxique, c'est l'efficacité du produit sur la pathologie étudiée qui est testée. "Seulement un tiers des produits testés franchiraient les essais de phase 1 et 2", explique Sciences et Avenir.
La phase 3 est le test sur un panel plus important, visant à prouver l'efficacité du médicament, en le comparant par exemple à un placebo. Il s'agit également d'évaluer les risques de ce médicament recoupés avec d'autres déjà pris par le patient. Enfin l'étape 4 intervient lors de la commercialisation. Il s'agit d'un suivi du médicament et des potentiels effets secondaires plus rares qu'il peut provoquer.
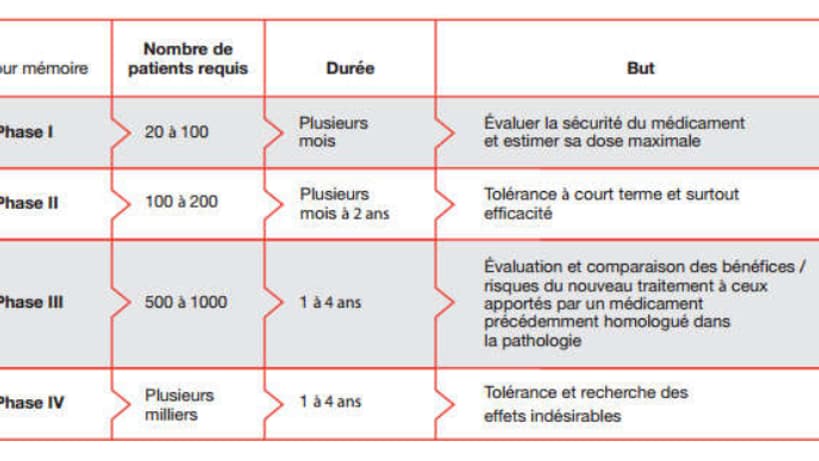
Entre le lancement de l'étude et la commercialisation du médicament peuvent s'écouler de nombreuses années, avec des tests effectués sur des centaines, voire plus d'un millier de personnes.
Qui peut y participer?
Des personnes malades comme en bonne santé peuvent se présenter à des essais cliniques. En revanche "être volontaire ne signifie pas qu’on sera automatiquement intégré dans un essai", explique l'Inserm (Institut national de la santé et de la recherche médicale).
"Chaque étude possède des critères d’inclusion, fondés sur l’âge, le sexe, le type et le stade de la maladie, les antécédents médicaux, les maladies associées", selon le médicament testé, explique l'Inserm. "Ces critères garantissent l’homogénéité des groupes, et donc l’obtention de résultats fiables, pertinents et robustes".
Les droits des personnes participant à un essai sont très encadrés par l'article L1122-1 du code de la Santé publique: ils ont par exemple le droit de connaître au cours de la recherche leur état de santé, peuvent se retirer de l'étude sans risque de poursuite et bien entendu, leur consentement éclairé pour participer à la rechercher doit être notifié par écrit.








