Coronavirus: course à l'innovation dans les tests rapides de diagnostic

Une véritable course contre la montre a été engagée pour mettre au point des tests de diagnostic du covid-19, dans l'attente d'un éventuel traitement. L'enjeu, mondial, consiste à mettre au point des tests détectant massivement en nombre de patients (et si possible rapidement en quelques heures voire moins) la présence du virus pour tester la population plus systématiquement et mieux contrôler ainsi l'évolution de la pandémie.
La France va monter en régime pour réaliser les tests détectant le coronavirus, avec "50.000 tests" classiques par jour d'ici fin avril, auxquels s'ajouteront "plus de 100.000" tests rapides par jour "au mois de juin", a déclaré samedi le ministre de la Santé Olivier Véran.
"Les tests rapides sont opérationnels, pour certains d'entre eux"
Les tests rapides "permettront d'avoir un résultat rendu en quelques minutes, 10, 15, 20 parfois 30 minutes selon les tests considérés", a-t-il dit. Ces nouveaux tests rapides sont en cours d'élaboration, voire "sont désormais opérationnels pour certains d'entre eux", a poursuivi le ministre, en citant des recherche en France, aux Etats-Unis, au Japon ou en Corée du Sud. Mais ces tests rapides ne traitent qu'un seul patient à la fois et semblent plutôt adaptés aux cas des patients à diagnostiquer d'urgence, ils sont plutôt complémentaires en termes d'utilisation.
Trois catégories bien distinctes de test de diagnostic sont dans le viseur aussi bien des industriels traditionnels du domaine que des biotechs. Tour d'horizon.
> Les tests classiques de diagnostic dit "PCR"
Sur le plan biologique, ces tests utilisent une technique d'"amplification" du matériel génétique viral du patient, couramment utilisée dans les diagnostics. Ils sont très sollicités et cruciaux actuellement dans la phase aiguë de la maladie. Ces tests doivent être réalisés par des laboratoires spécialisés en virologie. Basés sur la détection du code génétique du Covid-19, ils déterminent si un patient est infecté par le nouveau coronavirus au moment où il est pratiqué. Ces tests classiques, dits PCR, sont réalisés avec un échantillon pris à l'aide d'écouvillons dans le nez, et offrant des résultats en quelques heures sur des machines à "haut débit" de traitement.
> bioMerieux: le spécialiste française du diagnostic in vitro développe trois tests de diagnostic et indique avoir mis en place des "mesures exceptionnelles" pour faire en sorte d'en produire un maximum, sans donner de chiffres.
Un premier test, le SARS Cov-2 R-Gene, est en cours d'obtention du marquage CE (homologation européenne), mais il est validé en France où des laboratoires d'analyse l'utilisent déjà. Il s'agit d'un test PCR "temps réel" qui fournit un résultat en 4 à 5 heures sur un grand nombre de patients à la fois, dans le cas où il n'y a pas urgence à tester la positivité au covid-19 des malades. Le test est utilisable par les laboratoires d'analyse et leurs procédés actuels sans nécessiter l'acquisition d'une plateforme spécifique.
> Roche a reçu mi-mars l'autorisation d'utilisation d'urgence des autorités américaines, et la certification CE pour son test "cobas SARS-CoV-2", qui permet de détecter SARS-CoV-2 dans les prélèvements des patients. Le groupe pharmaceutique suisse dit pouvoir produire en tout 8,5 millions de tests par mois.
> Le français Eurobio Scientific a également annoncé récemment la mise au point d'un test permettant de détecter le SARS-COV-2, ayant obtenu le marquage CE. Il s'agit de la solution de la société sud-coréenne Seegene, qu'elle distribue en France et qui a obtenu l'aval des autorités françaises.
2. Les tests PCR de diagnostic rapide
Parallèlement à ces tests massifs aux résultats longs mais à la capacité de traitement sur des plateformes à haut débit, la course contre la montre de l'industrie se situe actuellement sur les tests rapides. Leur rapidité vient de la recherche de la présence de fragments du virus dans le patient malade. Mais ils ne traitent souvent qu'un seul patient à la fois et semblent donc plutôt adaptés aux patients à diagnostiquer d'urgence, ils sont complémentaires en termes d'utilisation des tests PCR classiques. Voici quelques uns des industriels impliqués dans ces tests rapides.
> BioMérieux a obtenu, selon une procédure dérogatoire, le droit de commercialiser aux Etats-Unis un test rapide du Covid-19. Ce test, Biofire Covid-19, détecte le coronavirus en 45 minutes "à partir d'un prélèvement rhinopharyngé réalisé avec un écouvillon". Il a été développé avec le soutien du département américain de la Défense qui en sera le premier destinataire. Il sera ensuite disponible sur le marché américain, puis à l'international en fonction des autorisations. Le groupe français est en train d'augmenter ses capacités de production dans la région de Salt Lake City (Utah, ouest des Etats-Unis), afin de parvenir à une capacité de production "maximale" de ce test "d'ici quelques semaines".
> Eurobio Scientific a mis au point son propre test coronavirus au niveau de la recherche. Il permettrait la détection rapide (1h15) des 3 gènes d’identification du virus SARS COv2 tel que recommandé par l’organisation Mondiale de la Santé (OMS). Eurobio Scientific prépare le marquage CE
> Toujours concernant la technologie PCR, la société strasbourgeoise Biosynex distribue un test rapide de la société singapourienne Credo Diagnostics Biomedical Ltd. Cette plateforme miniature de biologie moléculaire détecte des agents infectieux - dont le Covid-19 et les virus de la grippe - par PCR en 20 minutes maximum.
> Bosch: le groupe allemand a développé un test rapide en coopération avec le laboratoire Randox. Un échantillon pris dans le nez ou la gorge d'un patient est introduit, avec des réactifs, dans l'appareil de test, baptisé "Vivalytic", par le personnel soignant. Le résultat est donné au bout de deux heures et demie, sans devoir recourir à un laboratoire extérieur ou à du personnel spécialisé, assure Bosch. Ce test doit être disponible en Allemagne au mois d'avril (cf photo ci-dessous).

> Le laboratoire américain Abbott a reçu du gouvernement américain l'autorisation du dépistage du Covid-19 à l’aide d’ID Now, un mini-laboratoire mais qui ne peut réaliser qu'un test sur un patient à la fois. L'atout principal de ce test est son ultra-rapidité puisque son concepteur prétend obtenir un résultat de diagnostic positif en 5 mn et négatif en 12 mn maximum. Abbott rend disponible ces tests ID NOW COVID-19 cette semaine et prévoit d'accélérer la fabrication pour livrer 50 000 tests par jour.
D'autres entreprises, dont la société franco-britannique Novacyt, qui a également obtenu l'autorisation d'urgence de la Food and Drug administration pour son test, se sont lancées sur le créneau des tests .
> Tests de recherche d'anticorps à partir d'analyse de sang
La technique PCR ne sert pas à détecter une infection virale passée. Des sociétés se sont donc lancées sur des tests de sérologie (à partir de prélèvements sanguins), qui visent à détecter les anticorps pour déterminer après coup si un individu a été en contact avec le virus, et s'il est immunisé.
"Les tests sérologiques commencent à arriver dans le monde entier puisque ce sont des tests qui n'existaient pas. Il faut donc s'assurer de leur fiabilité, de leur sensibilité, et de leur capacité à n'avoir ni des faux négatifs, ni des faux positifs. Ces tests sont produits à la fois par des instituts de recherche et par des industriels. Et donc, l'objectif de la France est de disposer de tests fiables le plus vite possible et en plus grande quantité possible" a expliqué le directeur général de la Santé, Jérôme Salomon, hier mardi 31 mars, lors de son point presse quotidien.
En France, le test sérologique pourrait jouer un rôle crucial dans les prochaines semaines car il est envisagé pour un dépistage massif dans lequel semble vouloir s’engager le conseil scientifique du ministre de la Santé à l’issue de la période de confinement.
Plusieurs sociétés françaises se sont lancées sur ce marché.
> La société alsacienne Biosynex prévoit le lancement massif "à brève échéance d'un test sérologique rapide immunochromatographique de détection dans le sang des anticorps spécifiques du virus responsable du Covid-19". À part d'une goutte de sang, ce test permet de "détecter en 10 minutes les anticorps spécifiques du Covid-19 qui apparaissent environ 10 à 15 jours après la contamination". Le laboratoire précise que "cette détection sérologique permet de déterminer rétrospectivement l’exposition au virus de porteurs sains ou de patients ayant présenté des signes mineurs de l’infection au Covid-19." Selon Francebleu Alsace, "une fois le feu vert des autorités donné, la production pourrait être lancée lundi 6 avril en Chine, à raison de 100.000 tests fabriqués par jour. Ils seront ensuite acheminés dans les jours suivants via un pont aérien. A la mi-avril, 500.000 tests pourraient ainsi être disponibles en France".
> La biotech bretonne, installée près de Rennes, NG Biotech a lancé un test rapide du SARS-CoV-2.
"Ce test, pour lequel nous avons démarré les travaux de R&D il y a quatre mois, a été validé cliniquement en France", précise le docteur Alain Calvo, directeur du développement stratégique de NG Biotech.
Ce test rapide, fabriqué en France et désormais détenteur du marquage CE, est commercialisé sous forme d'un dispositif "tout-en-un", à usage unique, intégrant un auto-piqueur et un collecteur de sang capillaire et permettant une utilisation au chevet du patient comme en autotest, destiné dans ce cas en priorité aux personnels de santé.
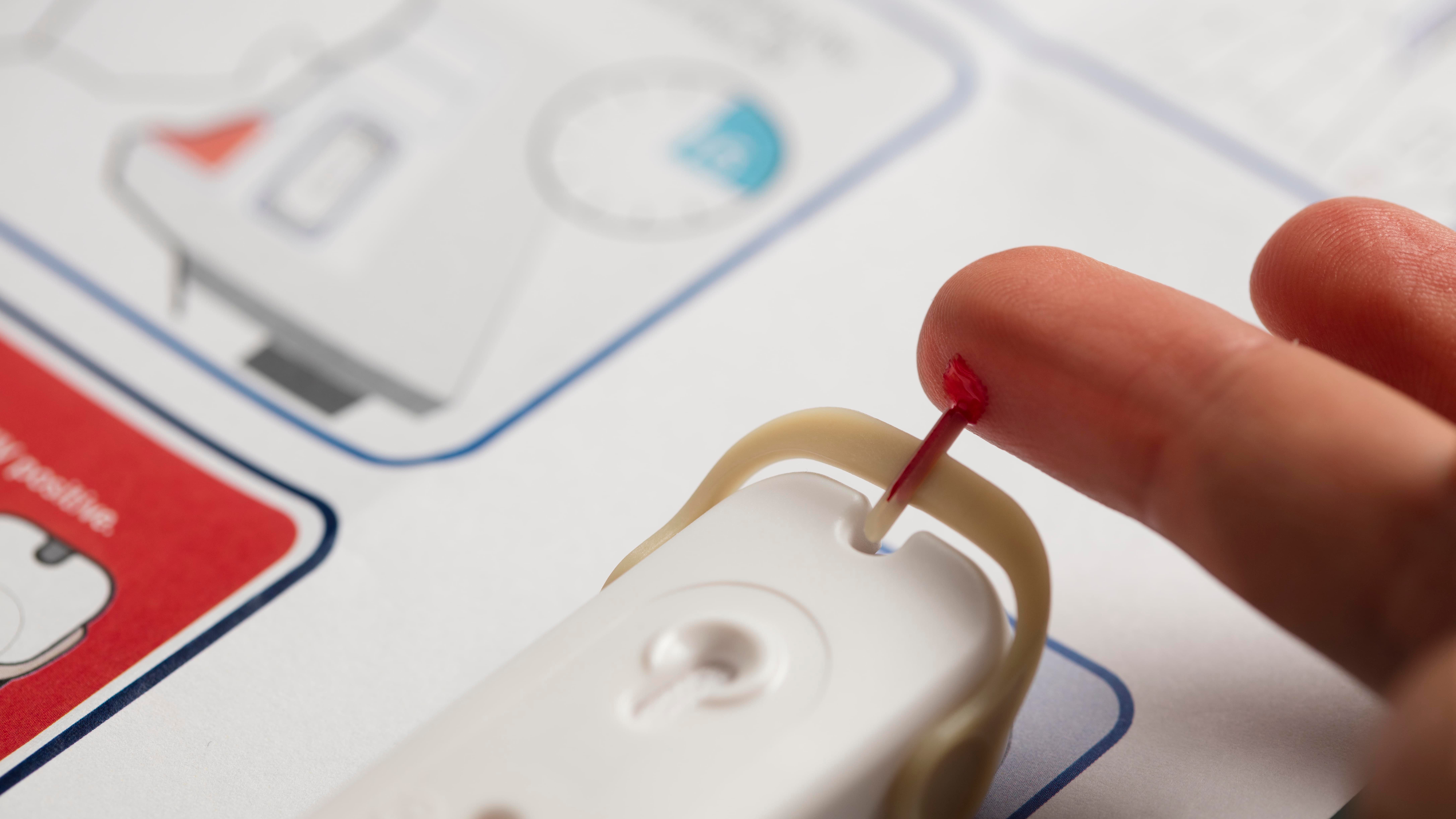
NG Biotech ouvre un 2ème site de production pour ce test avec pour objectif d’atteindre à court terme une capacité de production de l’ordre de 2 millions de tests par mois. Selon la biotech bretonne, une première commande lui a été passée tout récemment par l'État français: elle sera honorée dans le courant du mois d'avril.
> Eurobio Scientific annonce ce jour le marquage CE des tests SARS Cov-2 IgG et IgM CLIA* développés spécifiquement pour la sérologie des patients dans le but de connaître leur statut immunologique par rapport au COVID-19.
pensionnaires et personnel d'un ehpad à nancy soumis au dépistage sanguin
Les pensionnaires et le personnel d'un Ehpad municipal de Nancy vont être soumis à un dépistage systématique du Covid-19 par prise de sang, sans doute une "première nationale", a annoncé mardi le maire de Nancy Laurent Hénart. C'est établissement municipal d'hébergement des personnes âgées dépendantes (Ehpad) de 144 résidents et 90 agents.
Cette expérimentation, validée par l'Agence régionale de Santé (ARS) du Grand Est, est une première nationale, selon l'édile.
Ce dépistage par prise de sang permettra de mesurer le taux d'anticorps chez chaque personne prélevée et d'identifier ainsi celles qui n'ont pas été infectées par le Covid-19, celles qui sont en cours d'infection et celles qui sont immunisées.

